-
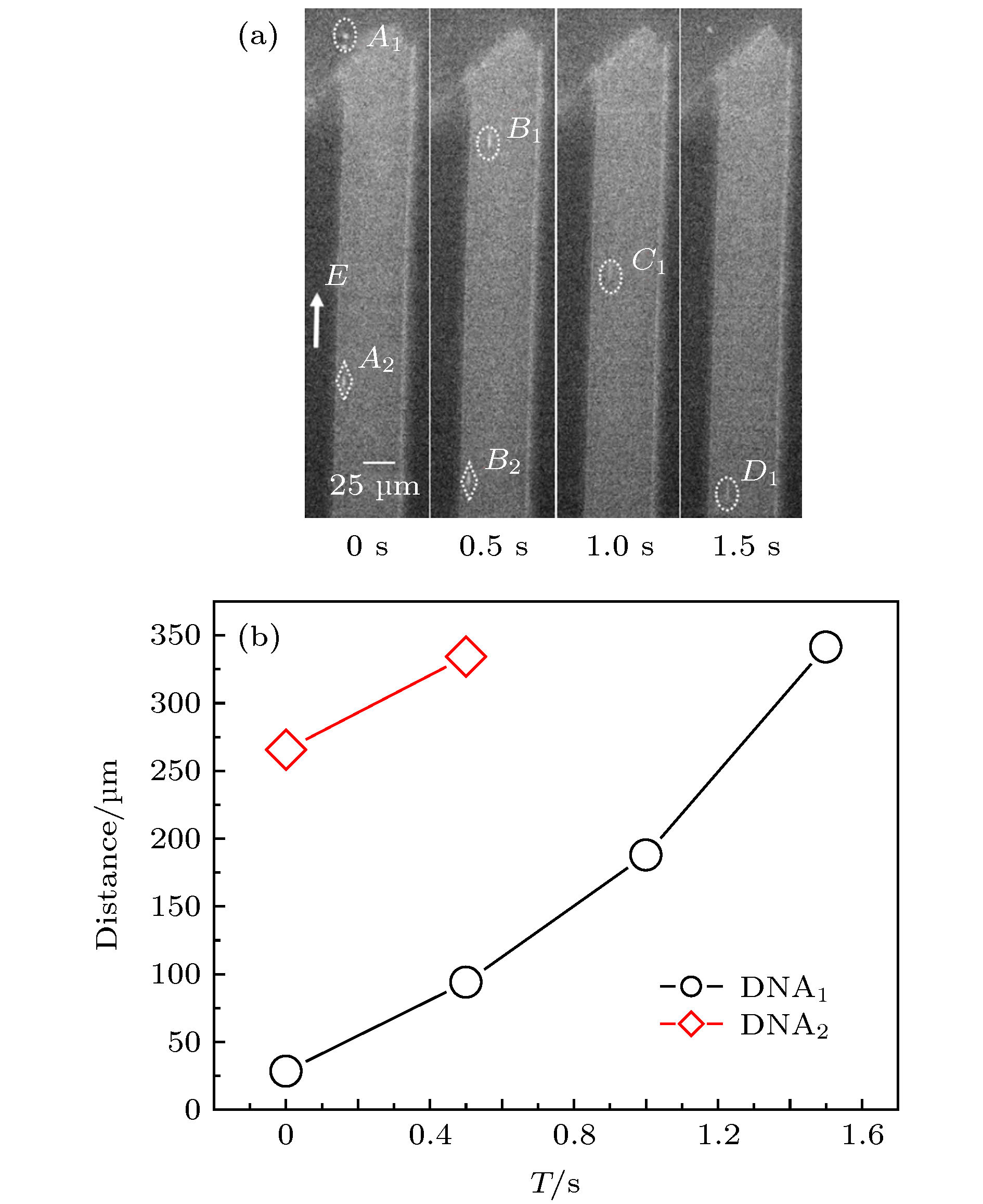
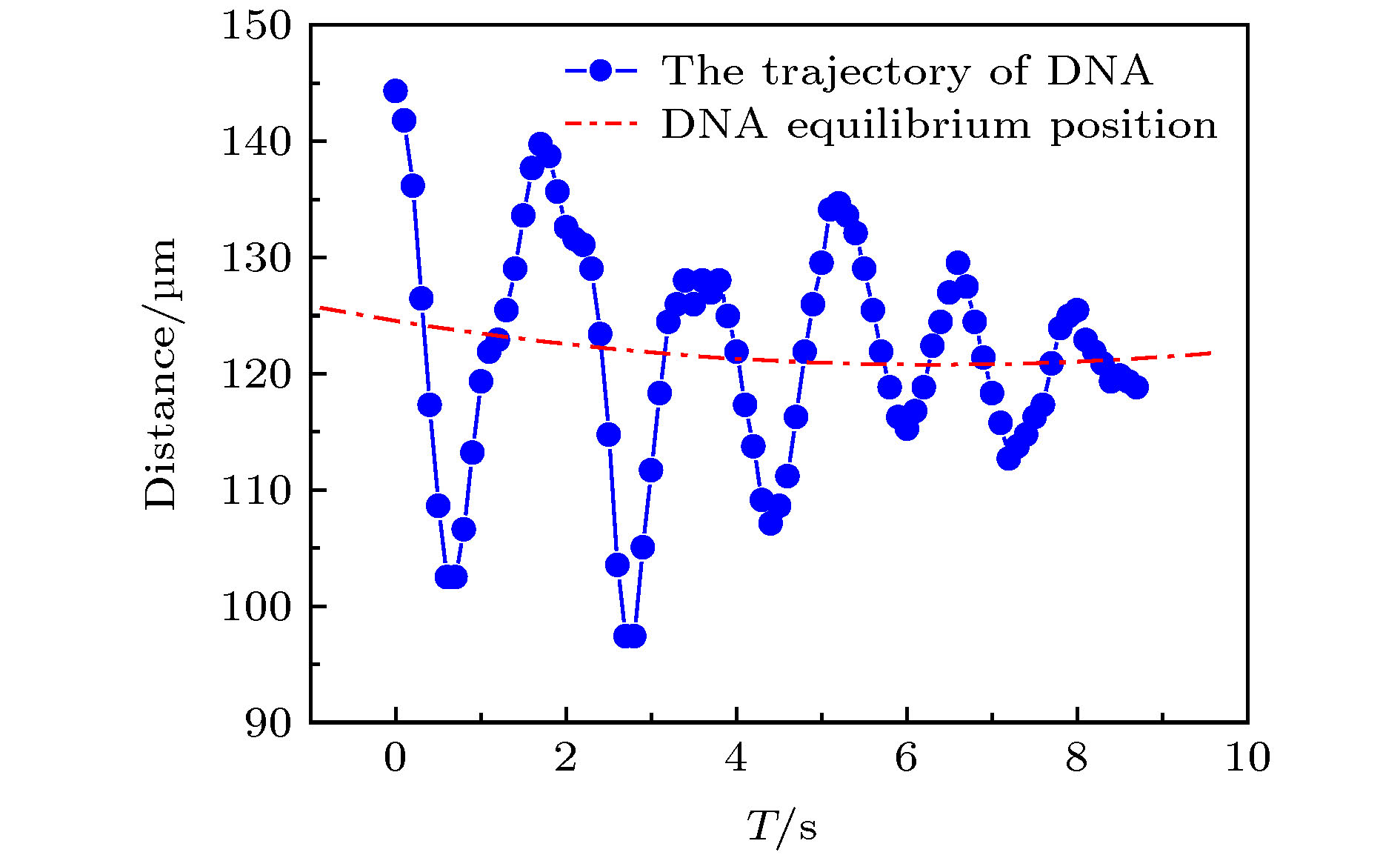
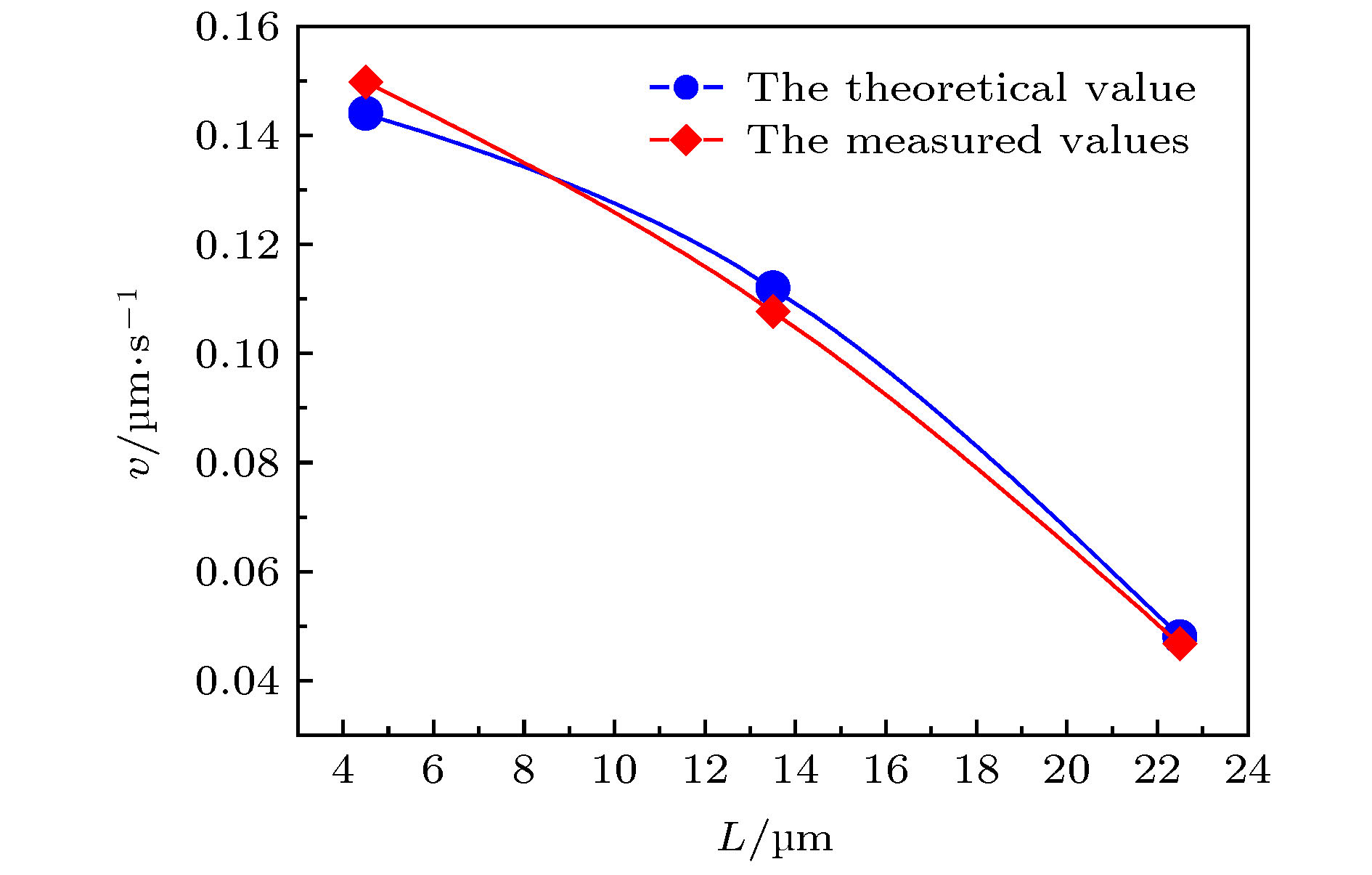
操控单个DNA分子, 将其有效引入、导出微纳通道是实现DNA生物芯片功能的前提条件. 本文利用单分子荧光显微成像技术系统地实时观察分析λ-DNA单分子在电场力驱动下进入/穿出50 μm通道端口处的电动力学特性及规律. 研究发现: λ-DNA分子能够顺利进入trans端口并穿出cis端口, 外加电场强度存在最大(Emax)和最小(Emin)阈值, 只有场强E满足: Emin≤E≤Emax时, λ-DNA分子才能进入trans端口并顺利穿出cis端口; 当电场强度小于最小阈值场强时, DNA分子不能进入trans端口; 当电场强度大于最大阈值场强时, λ-DNA分子虽可能从trans端口进入通道内部, 但不容易从cis端口穿出, 而是在迁移至通道内cis端口附近时, 运动方向反转、往复、甚至旋转等新现象, 并且易于粘附到管壁上; 随着场强增大, 反转位置距cis端口越大. 基于微流体电动力学理论, 对λ-DNA分子在微通道端口的不同运动状态的物理机制进行了初步分析. 本研究结果对研制基于微纳通道系统的基因芯片实验室及DNA分子传感器具有一定的实际指导意义.Manipulating a single DNA molecule and effectively introducing it into and exporting micro-nano-fluidic channels are prerequisites for the functional DNA biochips. And it is the key to the precise separation and screening of different DNA molecules by the micro-/nanochannel system that accurately understanding the movement characteristics and dynamic mechanism of DNA molecules moving near the channel port. In this paper, the electrodynamic characteristics of λ-DNA molecule entering into/leaving off a 50 μm channel port driven by the electric field force are systematically investigated and analyzed by the single molecule fluorescence microscopy. The experimental results indicated that there were the maximum (Emax) and minimum (Emin) thresholds of the applied electric field intensity, and only when the field intensity E meets Emin ≤ E ≤ Emax, the single λ-DNA molecule could successfully enter into the trans port and exit out of the cis port; when the electric field intensity was less than the minimum threshold, E ≤ Emin, λ-DNA molecules could not enter the trans port; when the electric field intensity was greater than the maximum threshold, Emax ≤ E, λ-DNA molecules could move into the microchannel through the trans port, but not exit out of the cis port. When λ-DNA molecule migrated toward the cis port along the channel, the movement state was changed, some new phenomena were observed, e.g. the translocation direction was reversed, reciprocated, or even rotated; moreover, the DNA molecules were easy to adhere to the channel wall. In addition, when the electric field intensity enhanced, the distance between the position where DNA molecular direction reversing and the cis port was increased. Based on the microfluidic electrodynamics, the physical mechanism of the velocities and translocation states of single λ-DNA molecule passing microchannel port was preliminarily analyzed. The results of this study have certain practical guiding significance for the development of gene chip laboratory and DNA molecular sensors based on the micro/nanochannel fluidic system.
-
Keywords:
- λ-DNA molecule /
- single molecule fluorescence imaging technology /
- micro/nanofluidic channel /
- reversal movement
[1] Streets A M, Huang Y 2014 Curr. Opin. Biotechnol. 25 69
 Google Scholar
Google Scholar
[2] Atalay Y T, Vermeir S, Witters D, Vergauwe N, Verbruggen B, Verboner P, Nicolai B M, Lammertyn J 2011 Trends Food Sci. Technol. 22 386
 Google Scholar
Google Scholar
[3] Rivet C, Lee H, Hirsch A, Hamilton S, Lu H 2011 Chem. Eng. Sci. 66 1490
 Google Scholar
Google Scholar
[4] David E, Mandal S, Yang A H J, Bernardoc C 2008 Microfluid. Nanofluid. 4 33
 Google Scholar
Google Scholar
[5] Branton D, Deamer D W, Marziali A, Bayley H 2008 Nat. Biotechnol. 26 1146
 Google Scholar
Google Scholar
[6] Wang K G, Yue S L, Wang L, Jin A, Chang Z G, Wang P Y, Feng Y C, Wang Y C, Niu H B 2006 Microfluid. Nanofluid. 2 85
 Google Scholar
Google Scholar
[7] Rief M, Clausen-Schaumann H, Gaub H E 1999 Nat. Struct. Biol. 6 346
 Google Scholar
Google Scholar
[8] Aksimentiev A, Schulten K 2005 Biophys. J. 88 3745
 Google Scholar
Google Scholar
[9] Wells D B, Abramkina V, Aksimentiev A 2007 J. Chem. Phys. 127 5101
[10] Rose D J, Jorgenson J R, Jorgenson J W 1988 J. Anal. Chem. 60 642
 Google Scholar
Google Scholar
[11] 陈义, 竺安 1991 色谱 6 353
Chen Y, Zhu A 1991 Chin. J. Chrom. 6 353
[12] Linhares M C, Kissinger P T 1991 J. Anal. Chem. 63 2076
 Google Scholar
Google Scholar
[13] Lee C H, Hesish C C 2013 Biomicrofluidics 7 044106
 Google Scholar
Google Scholar
[14] Renner C B, Patrick S D 2015 Soft Matter 11 3105
 Google Scholar
Google Scholar
[15] Wang H Q, Wang K G, Ma H W 2016 J. Nanosci. Nanotechno. 16 6986
 Google Scholar
Google Scholar
[16] Yang F Y, Wang K G, Sun D, Zhao W, Wang H Q, He X, Wang G R, Bai J T 2016 Chin. Phys. B 25 529
[17] Jones P V, Salmon G L, Ros A 2017 J. Anal. Chem. 89 1531
 Google Scholar
Google Scholar
[18] Marie R, Beech J P, Vörös J, Tegenfeldt J O 2006 Langmuir 22 10103
 Google Scholar
Google Scholar
[19] Mitchell M J, Qiao R, Aluru N R 2000 J. Microelectromech. Syst. 9 435
 Google Scholar
Google Scholar
[20] 李战华 2012 微流控芯片中的流体流动 (北京: 科学出版社) 第191页
Li Z H 2012 Fluid Flow in Microfluidic Chips (Beijing: Science Press) p191 (in Chinese)
[21] Uehara S, Shintaku H, Kawano S 2011 J. Fluids Eng. 133 121203
 Google Scholar
Google Scholar
[22] Firnkes M, Pedone D, Knezevic J, Dolinger M 2010 Nano Lett. 10 2162
 Google Scholar
Google Scholar
[23] Schoch R B, Han J, Renaud P 2008 Rev. Mod. Phys. 80 839
 Google Scholar
Google Scholar
[24] Perkins T T, Smith D, Chu S 1994 Science 264 822
 Google Scholar
Google Scholar
[25] 高峰, 石则满, 冯鑫 2017 传感器与微系统 11 53
Gao F, Shi Z M, Feng X 2017 Tansducer. Microsystem. 11 53
[26] 陈凌珊, 周建华, 仕康 1993 工程热物理学报 3 336
Chen L S, Zhou J H, Wang S K 1993 J. Eng. Therm. 3 336
[27] 朱红, 周亚 2010 自然科学学报 32 45
Zhou H, Zhou Y T 2010 J. Nat. Sci. 32 45
[28] Sparreboom W, Van Den Berg A, Eijkel J C T 2009 Nat. Nanotechnol. 4 713
 Google Scholar
Google Scholar
[29] Tang J, Du N, Doyle P S 2011 Proc. Natl. Acad. Sci. U. S. A. 108 16153
 Google Scholar
Google Scholar
[30] Saffman P G 1965 J. Fluid Mech. 22 385
 Google Scholar
Google Scholar
[31] Magnus G 1853 Ann. Phys. 164 1
 Google Scholar
Google Scholar
-
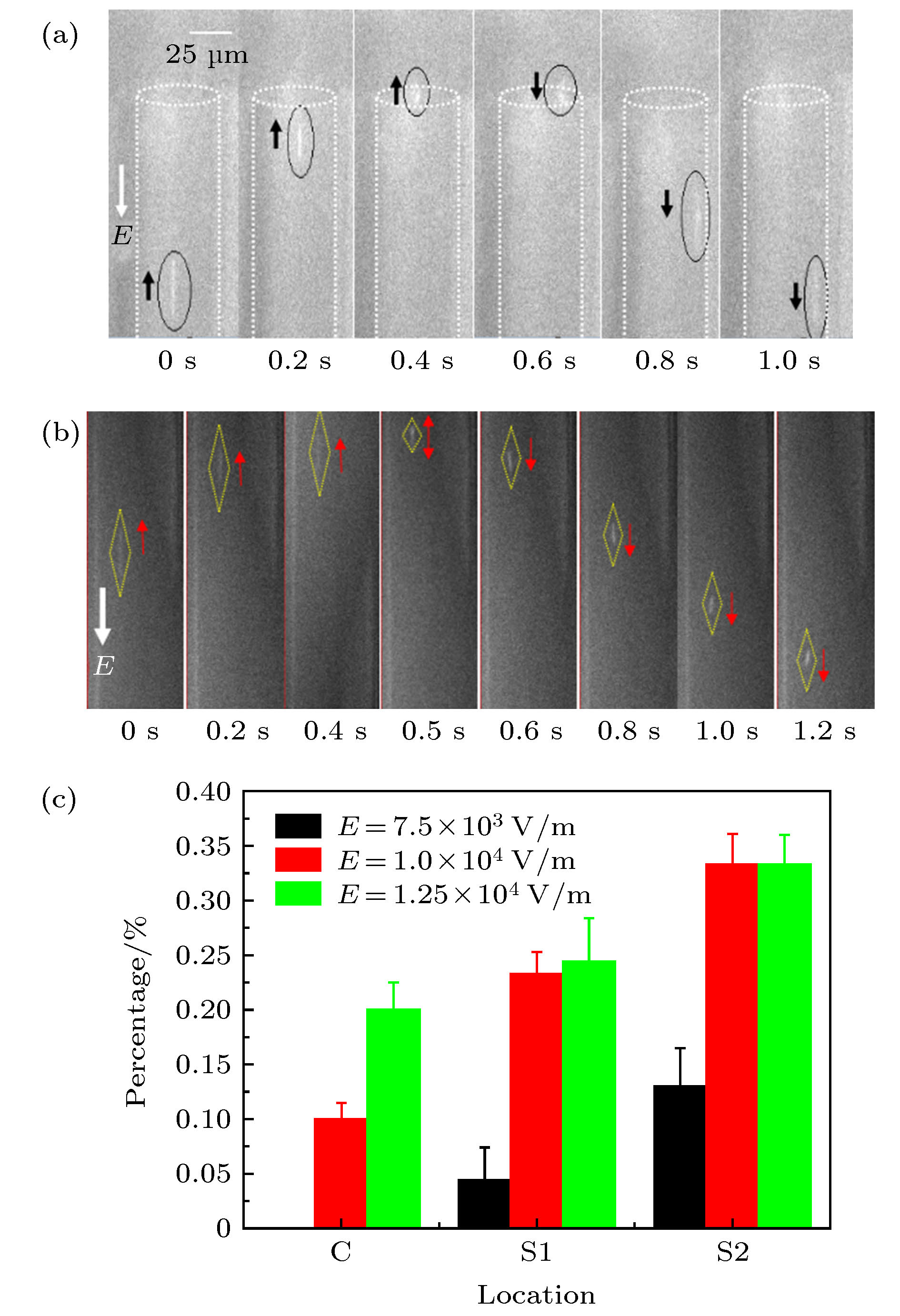
图 4 DNA分子在微通道内的反转运动 (a) E = 8.125 × 103 V·m–1; (b) E = 9.375 × 103 V·m–1; (c) 不同电场强度下, 在cis端口不同区域内的DNA分子反转数占总数的百分比
Fig. 4. Reversed motion of DNA molecules within micro channel under different electric intensity: (a) E = 8.125 × 103 V·m–1; (b) E = 9.375 × 103 V·m–1; (c) percentage of DNA molecules with reversal motion direction in different regions of the cis port under different electric intensity.
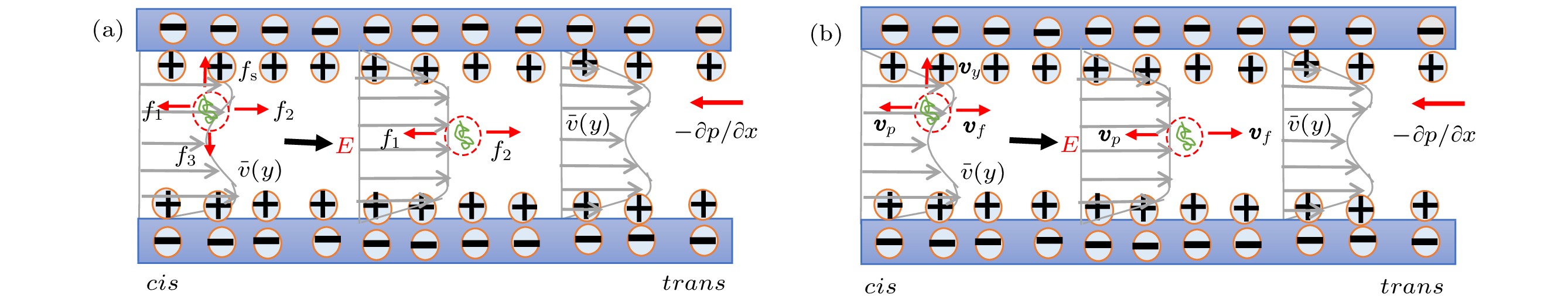
图 10 DNA分子在微米通道内端口附近处的反转运动示意图 (a) DNA分子在cis端口处反转, 反转后的DNA分子容易吸附在微米通道内管壁上, 7.5 × 103 V·m–1 ≤ E ≤ 1 × 104 V·m–1; (b) DNA分子在trans端口附近的反转运动, E > 1 × 104 V·m–1
Fig. 10. Schematic diagram of DNA molecules moving near the port of microchannel: (a) reversing near the cis port, and the reversed DNA molecule is easy to be adsorbed onto the inner wall, 7.5 × 103 V·m–1 ≤ E ≤ 1 × 104 V·m–1; (b) reversing near the trans port, E > 1 × 104 V·m–1.
-
[1] Streets A M, Huang Y 2014 Curr. Opin. Biotechnol. 25 69
 Google Scholar
Google Scholar
[2] Atalay Y T, Vermeir S, Witters D, Vergauwe N, Verbruggen B, Verboner P, Nicolai B M, Lammertyn J 2011 Trends Food Sci. Technol. 22 386
 Google Scholar
Google Scholar
[3] Rivet C, Lee H, Hirsch A, Hamilton S, Lu H 2011 Chem. Eng. Sci. 66 1490
 Google Scholar
Google Scholar
[4] David E, Mandal S, Yang A H J, Bernardoc C 2008 Microfluid. Nanofluid. 4 33
 Google Scholar
Google Scholar
[5] Branton D, Deamer D W, Marziali A, Bayley H 2008 Nat. Biotechnol. 26 1146
 Google Scholar
Google Scholar
[6] Wang K G, Yue S L, Wang L, Jin A, Chang Z G, Wang P Y, Feng Y C, Wang Y C, Niu H B 2006 Microfluid. Nanofluid. 2 85
 Google Scholar
Google Scholar
[7] Rief M, Clausen-Schaumann H, Gaub H E 1999 Nat. Struct. Biol. 6 346
 Google Scholar
Google Scholar
[8] Aksimentiev A, Schulten K 2005 Biophys. J. 88 3745
 Google Scholar
Google Scholar
[9] Wells D B, Abramkina V, Aksimentiev A 2007 J. Chem. Phys. 127 5101
[10] Rose D J, Jorgenson J R, Jorgenson J W 1988 J. Anal. Chem. 60 642
 Google Scholar
Google Scholar
[11] 陈义, 竺安 1991 色谱 6 353
Chen Y, Zhu A 1991 Chin. J. Chrom. 6 353
[12] Linhares M C, Kissinger P T 1991 J. Anal. Chem. 63 2076
 Google Scholar
Google Scholar
[13] Lee C H, Hesish C C 2013 Biomicrofluidics 7 044106
 Google Scholar
Google Scholar
[14] Renner C B, Patrick S D 2015 Soft Matter 11 3105
 Google Scholar
Google Scholar
[15] Wang H Q, Wang K G, Ma H W 2016 J. Nanosci. Nanotechno. 16 6986
 Google Scholar
Google Scholar
[16] Yang F Y, Wang K G, Sun D, Zhao W, Wang H Q, He X, Wang G R, Bai J T 2016 Chin. Phys. B 25 529
[17] Jones P V, Salmon G L, Ros A 2017 J. Anal. Chem. 89 1531
 Google Scholar
Google Scholar
[18] Marie R, Beech J P, Vörös J, Tegenfeldt J O 2006 Langmuir 22 10103
 Google Scholar
Google Scholar
[19] Mitchell M J, Qiao R, Aluru N R 2000 J. Microelectromech. Syst. 9 435
 Google Scholar
Google Scholar
[20] 李战华 2012 微流控芯片中的流体流动 (北京: 科学出版社) 第191页
Li Z H 2012 Fluid Flow in Microfluidic Chips (Beijing: Science Press) p191 (in Chinese)
[21] Uehara S, Shintaku H, Kawano S 2011 J. Fluids Eng. 133 121203
 Google Scholar
Google Scholar
[22] Firnkes M, Pedone D, Knezevic J, Dolinger M 2010 Nano Lett. 10 2162
 Google Scholar
Google Scholar
[23] Schoch R B, Han J, Renaud P 2008 Rev. Mod. Phys. 80 839
 Google Scholar
Google Scholar
[24] Perkins T T, Smith D, Chu S 1994 Science 264 822
 Google Scholar
Google Scholar
[25] 高峰, 石则满, 冯鑫 2017 传感器与微系统 11 53
Gao F, Shi Z M, Feng X 2017 Tansducer. Microsystem. 11 53
[26] 陈凌珊, 周建华, 仕康 1993 工程热物理学报 3 336
Chen L S, Zhou J H, Wang S K 1993 J. Eng. Therm. 3 336
[27] 朱红, 周亚 2010 自然科学学报 32 45
Zhou H, Zhou Y T 2010 J. Nat. Sci. 32 45
[28] Sparreboom W, Van Den Berg A, Eijkel J C T 2009 Nat. Nanotechnol. 4 713
 Google Scholar
Google Scholar
[29] Tang J, Du N, Doyle P S 2011 Proc. Natl. Acad. Sci. U. S. A. 108 16153
 Google Scholar
Google Scholar
[30] Saffman P G 1965 J. Fluid Mech. 22 385
 Google Scholar
Google Scholar
[31] Magnus G 1853 Ann. Phys. 164 1
 Google Scholar
Google Scholar
计量
- 文章访问数: 10762
- PDF下载量: 92
- 被引次数: 0













 下载:
下载: